ЕГЭ Химия Классификация органических и неорганических веществ
Почему важно знать классификацию веществ? Во-первых – это твой фундамент, который послужит отличным ориентиром при выполнении различных заданий. Так сведем же воедино всю теорию по пункту классификации в данной статье!
Известно, что свойства органических веществ определяются их составом и химическим строением. Поэтому неудивительно, что в основе классификации органических соединений лежит именно теория строения — теория Л. М. Бутлерова. Классифицируют органические вещества по наличию и порядку соединения атомов в их молекулах. Наиболее прочной и малоизменяемой частью молекулы органического вещества является ее скелет — цепь атомов углерода. В зависимости от порядка соединения атомов углерода в этой цепи вещества делятся на ациклические, не содержащие замкнутых цепей атомов углерода в молекулах, и карбоциклические, содержащие такие цени (циклы) в молекулах.
Помимо атомов углерода и водорода молекулы органических веществ могут содержать атомы и других химических элементов. Вещества, в молекулах которых эти так называемые гетероатомы включены в замкнутую цепь, относят к гетероциклическим соединениям.
Гетероатомы (кислород, азот и др.) могут входить в состав молекул и ациклических соединений, образуя в них функциональные группы, например, гидроксильную — ОН, карбонильную, карбоксильную, аминогруппу —NН2.
Функциональная группа — группа атомов, которая определяет наиболее характерные химические свойства вещества и его принадлежность к определенному классу соединений.
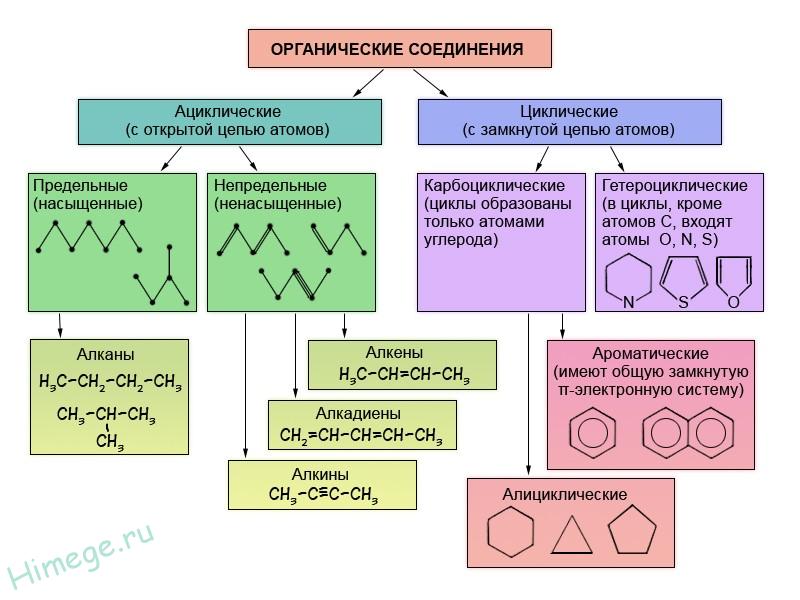
Углеводороды — это соединения, состоящие только из атомов водорода и углерода.
В зависимости от строения углеродной цепи органические соединения разделяют на соединения с открытой цепью — ациклические (алифатические) и циклические — с замкнутой цепью атомов.
Циклические делятся на две группы: карбоциклические соединения (циклы образованы только атомами углерода) и гетероциклические (в циклы входят и другие атомы, такие как кислород, азот, сера).
Карбоциклические соединения, в свою очередь, включают два ряда соединений: алицикличвские и ароматические.
Ароматические соединения в основе строения молекул имеют плоские углеродсодержащие циклы с особой замкнутой системой р-электронов, образующих общую π-систему (единое π-электронное облако). Ароматичность характерна и для многих гетероциклических соединений.
Все остальные карбоциклические соединения относятся к алициклическому ряду.
Как ациклические (алифатические), так и циклические углеводороды могут содержать кратные (двойные или тройные) связи. Такие углеводороды называют непредельными (ненасыщенными) в отличие от предельных (насыщенных), содержащих только одинарные связи.

Таким образом, если в их молекулах один или большее число атомов водорода заменить на другие атомы или группы атомов (галогены, гидроксильные группы, аминогруппы и др.), образуются производные углеводородов: галогенопроизводные, кислородсодержащие, азотсодержащие и другие органические соединения.
Галогенопроизводные углеводородов можно рассматривать как продукты замещения в углеводородах одного или нескольких атомов водорода атомами галогенов. В соответствии с этим могут существовать предельные и непредельные моно-, ди-, три- (в общем случае поли-) галогенопроизводные.
Общая формула моногалогенопроизводных предельных углеводородов: R-Г, а состав выражается формулой , где R — остаток от предельного углеводорода (алкана), углеводородный радикал (это обозначение используется и далее при рассмотрении других классов органических веществ), Г — атом галогена (F, Сl, Вг, I).
К кислородсодержащим органическим веществам относят спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры.
Спирты — производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильные группы.
Спирты называют одноатомными, если они имеют одну гидроксильную группу, и предельными, если они являются производными алканов.
Общая формула предельных одноатомных спиртов: R-OH, а их состав выражается общей формулой: .
Известны примеры многоатомных спиртов, т. е. имеющих несколько гндроксильных групп.
Фенолы — производные ароматических углеводородов (ряда бензола), в которых один или несколько атомов водорода в бензольном кольце замещены на гидроксильные группы.
Простейший представитель с формулой С6Н5ОН называется фенолом.
Альдегиды и кетоны — производные углеводородов, содержащие карбонильную группу атомов (карбонил).
В молекулах альдегидов одна связь карбонила идет на соединение с атомом водорода, другая — с углеводородным радикалом.
В случае кетонов карбонильная группа связана с двумя (в общем случае разными) радикалами.
Состав предельных альдегидов и кетонов выражается формулой СnН2лО.
Карбоновые кислоты — производные углеводородов, содержащие карбоксильные группы (—СООН).
Если в молекуле кислоты одна карбоксильная группа, то карбоновая кислота является одноосновной. Общая формула предельных одноосновных кислот (R-СООН). Их состав выражается формулой СnН2nO2.
Простые эфиры представляют собой органические вещества, содержащие два углеводородных радикала, соединенных атомом кислорода: R—О—R или R1-O-R2.
Радикалы могут быть одинаковыми или разными. Состав простых эфиров выражается формулой СnН2n+2O
Сложные эфиры — соединения, образованные замещением атома водорода карбоксильной группы в карбоновых кислотах на углеводородный радикал.
Из азотсодержащих органических веществ известны нитро соединения, амины и аминокислоты.
Нитросоединения — производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу —NO2.
Общая формула предельных мононитросоединений:
R-NO2,
а состав выражается общей формулой
СnН2n+1NO2.
Амины — соединения, которые рассматривают как производные аммиака (NН3), в котором атомы водорода замещены на углеводородные радикалы.
В зависимости от природы радикала амины могут быть алифатическими и ароматическими.
В зависимости от числа замещенных на радикалы атомов водорода различают:
- первичные амины с общей формулой: R-NН2
- вторичные — с общей формулой: R1-NН-R2
- третичные — с общей формулой:
R1-NR2-R3
В частном случае у вторичных, а также третичных аминов радикалы могут быть и одинаковыми.
Первичные амины можно также рассматривать как производные углеводородов (алканов), в которых один атом водорода замещен на аминогруппу —NН2. Состав предельных первичных аминов выражается формулой СnН2n+3N.
Аминокислоты содержат две функциональные группы, соединенные с углеводородным радикалом: аминогруппу —NН2, и карбоксил —СООН.
Состав предельных аминокислот, содержащих одну аминогруппу и один карбоксил, выражается формулой СnН2n+1NO2.
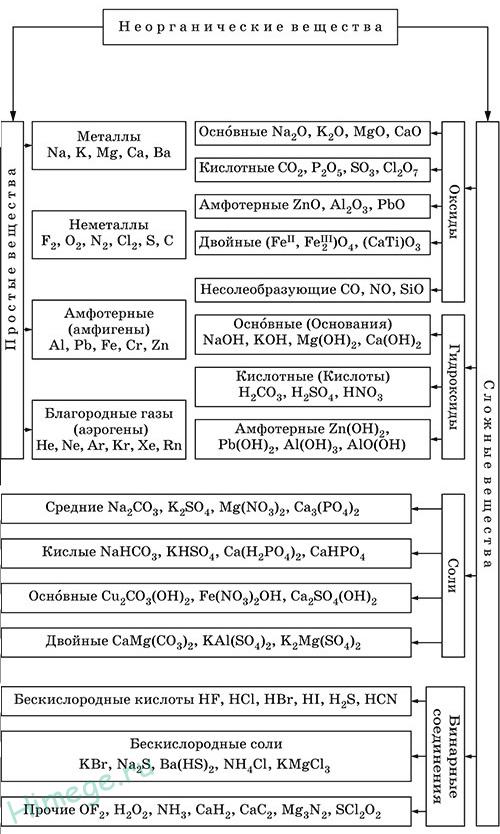
Оксиды – соединения элементов с кислородом, степень окисления кислорода в оксидах всегда равна -2.
Оснóвные оксиды образуют типичные металлы со С.О. +1,+2 (Li2O, MgO, СаО,CuO и др.).
Кислотные оксиды образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2,SiO2 , CrO3 и Mn2O7). Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными.
Амфотерные оксиды образованы амфотерными металлами со С.О. +2,+3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
Несолеобразующие оксиды – оксиды неметаллов со С.О.+1,+2 (СО, NO, N2O, SiO).
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из иона металла (или иона аммония) и гидроксогруппы (-OH).
Кислотные гидроксиды (кислоты) — сложные вещества, которые состоят из атомов водорода и кислотного остатка.
Амфотерные гидроксиды образованы элементами с амфотерными свойствами.
Соли – сложные вещества, образованные атомами металлов, соединёнными с кислотными остатками.
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назвать кислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.
Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия
Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назвать основную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН — групп, входящих в состав соли.
Например, (CuOH)2CO3 — гидроксокарбонат меди (II).
Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Например,KAl(SO4)2, KNaSO4.
Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.